研究揭示了对SARS-CoV-2的早期免疫反应,为未来的COVID-19治疗提供了见解

最近发表在《Nature》杂志上的一项研究中,一组研究人员利用单细胞多组学分析,分析了血清阴性个体对 SARS-CoV-2 的早期细胞反应动力学,确定了与不同感染结果相关的关键细胞状态和免疫反应。
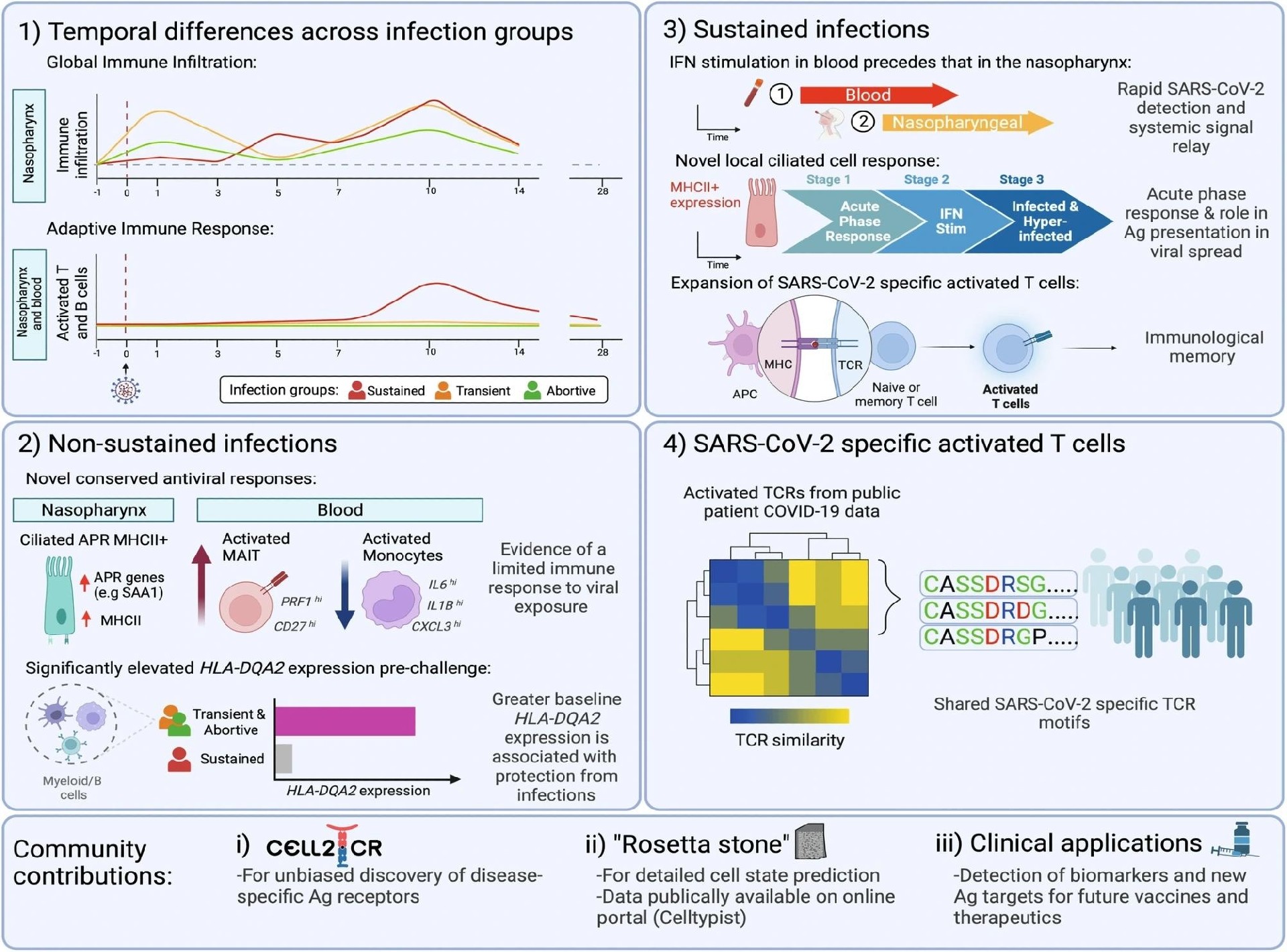
图:人类SARS-CoV-2挑战揭示了局部和系统的反应动力学
摘要图突出了研究的主要发现。这些包括:1)在不同感染组之间观察到的细胞动力学存在明显的时间差异;2)暴露于病毒但未继续发展为持续感染的参与者中有几种新的保守抗病毒反应和更高的HLA-DQA2基线表达;3)持续感染的新特征,与接种部位相比,在血液中观察到快速的传递,在感染早期(症状前期)发生动态的局部纤毛反应,以及暂时受限的、独特的、SARS-CoV-2特异性激活的T细胞群,导致免疫记忆;4) SARS-CoV-2特异性活化T细胞中公共基序的鉴定。此外,我们的工作为推断活化T细胞中特定的TCR基序(Cell2TCR)提供了社区工具,这是一个详细的公开可用的参考数据库,为检测未来的生物标志物和抗原(Ag)靶点提供了基础。

研究背景
由 SARS-COV-2 引起的 COVID-19 是一种潜在的致命疾病,已经成为全球严重的卫生紧急情况。严重的后果与破坏抗病毒和免疫反应有关,包括受损的 I 型干扰素反应和改变 T淋巴细胞(T)和 B淋巴细胞(B)细胞动态。由于不同的因素,如病毒剂量、毒株和合并感染等临床特征,精确检测免疫应答具有挑战性。了解 SARS-COV-2 感染的动态变化,特别是接触的早期阶段,是至关重要的。研究往往忽略了在自然感染中捕捉这些早期事件,这使得精确定位抗原应答 T细胞激活和扩张困难。需要进一步的研究,以准确描述对 SARS-COV-2 的早期免疫反应动力学,从而更好地理解和减轻严重的 COVID-19 结果。
关于该项研究
16 名年龄在 18-30 岁的健康成年人参加了人类 SARS-COV-2 挑战研究,进行单细胞 RNA 测序(scRNA-seq)样本处理和分析。这项研究由伦敦帝国理工学院、皇家自由伦敦国民保健服务基金会信托基金、伦敦大学学院和哈弗里的一个政府工作队于 2021 年 6 月 至 8 月进行。此外,来自早期队列的 20 名健康成年人进行了血液和鼻咽样本的大量核糖核酸 (RNA)测序处理以后,有 10 人接受先发制人的治疗。志愿者接受了 SARS-COV-2 抗体的筛查,如果阳性则排除在外。这项研究遵循了道德准则,并获得了所有志愿者的知情同意。
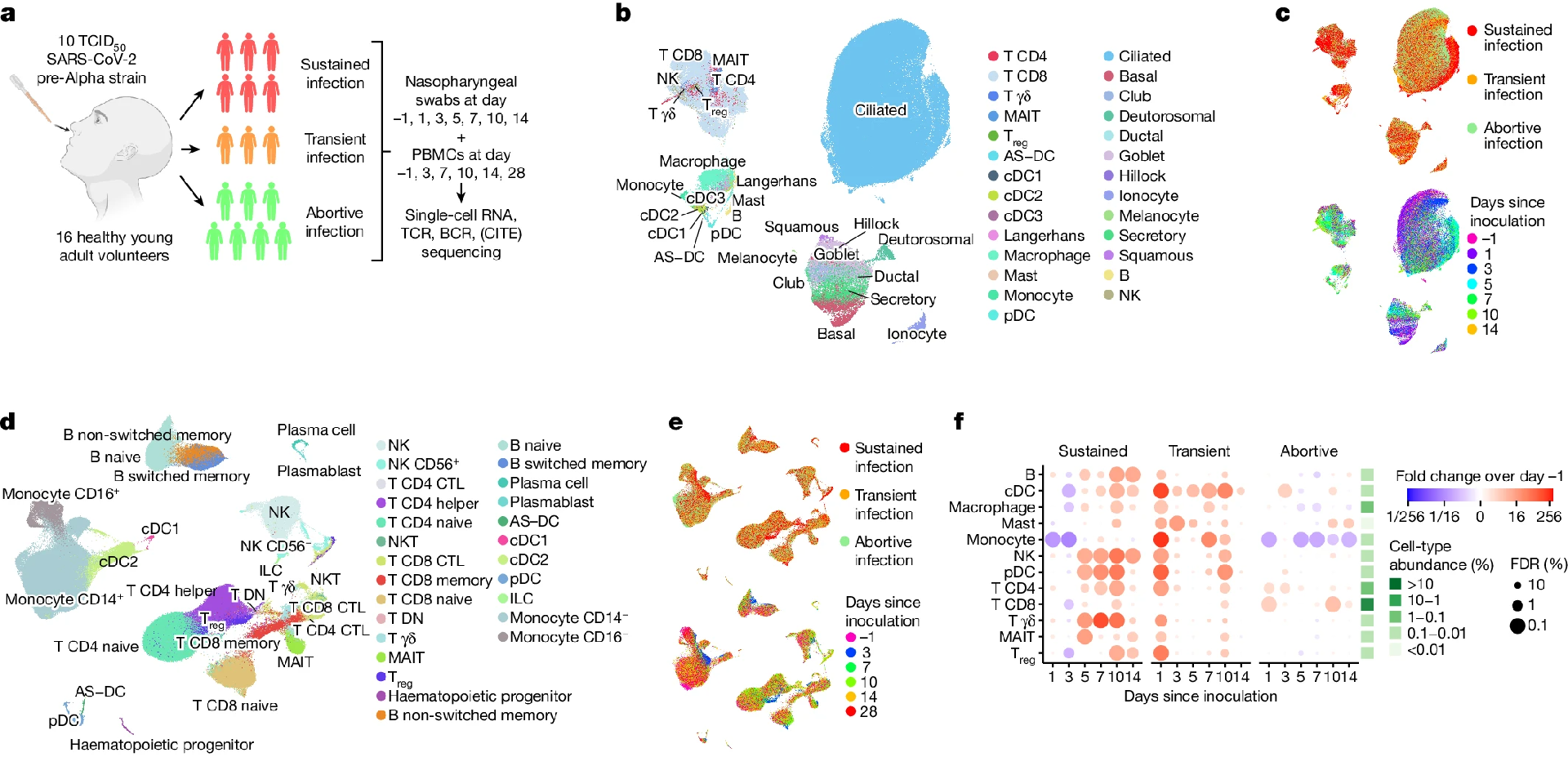
图:a. 研究设计和队列组成说明。b,c. 所有鼻咽细胞(n=234,182) 的均匀歧形近似和投影 (UMAP) 图,按其广泛的细胞类型注释 (b),感染组 (c,顶部) 和接种后天数 (c,底部) 进行颜色编码。只有来自持续感染病例的细胞显示在底部的 c 中。Treg,调节性T细胞; AS-DC, AXL+SIGLEC6+树突状细胞。d,e. UMAP图如b和c所示,但显示所有pbmc (n=371,892)。CTL,细胞毒性T淋巴细胞;DN,双重否定。f. 鼻咽部广泛免疫细胞类型丰度的 Fold 变化。免疫细胞丰度按比例计算每个样本中检测到的上皮细胞总数,然后通过拟合 GLMM 计算接种后与感染前 (第1天) 相比的倍数变化。拟合的褶皱变化是彩色编码的,我们使用局部真符号率和 Benjamini-Hochberg 程序来计算错误发现率 (FDRs),它显示为每个点的大小。点图右边的绿色热图显示了所有细胞和样本的平均细胞型比例,以帮助解释细胞型丰度的变化。
11 名参与者,接种前抗体水平低,被归类为流产感染,这没有改变研究的结论。接种后对参与者进行了一年的随访,在最后的时间点没有报告长时间的 Covid 症状。生理观察正常。出院后,两名参与者报告在第 28 天随访前接受了疫苗或社区感染。酶联免疫斑点 (ELISpot) 检测显示随后的样品有免疫应答。参与者经鼻接种了野生型前 α型 SARS-CoV-2 病毒,并收集了鼻腔和喉咙样本以评估病毒动力学。处理鼻咽拭子和外周血单核细胞 (PBMCs) 进行单细胞测序以分析免疫应答。
研究结果
在本研究中,16 名血清阴性的年轻人经鼻接种了前 α 型 SARS-CoV-2 病毒株。广泛筛查排除了有严重疾病危险因素或合并症的参与者。参与者接受最低的可量化接种剂量,没有导致严重的不良事件和缓解的症状。
该研究分析了单细胞分辨率下的局部和系统免疫反应。在接种前进行基线测量,随后进行血液和鼻咽细胞反应的时间序列分析。6 名参与者发展为持续感染,通过连续的病毒载量检测和症状来定义。3 个人进行了零星阳性聚合物链反应 (PCR) 试验,并被归类为暂时感染。7名参与者仍然是 PCR 阴性,但显示早期先天免疫反应,称为流产性感染。感染率与未接种疫苗的封闭家庭中的感染率相似。
在多达 7 个时间点进行 scRNA-seq 和单细胞 T细胞受体 (TCR) 和 B细胞受体 (BCR) 测序。转录组和表位的细胞索引测序 (CITE-seq) 定量了 123 个 pbmc 表面蛋白。共生成了 60 多万个单细胞转录组,包括 371,892 个 pbmc 和 234,182 个鼻咽细胞。预测模型和标记基因表达注释了 202 个细胞状态,使详细的局部和系统反应分析成为可能。
广义线性混合模型 (GLMMS) 量化了细胞型丰度随时间的变化。暴露于 SARS-CoV-2 后免疫细胞类型浸润接种部位。持续感染在第 5 天开始出现免疫浸润,而短暂感染在第 1 天立即出现免疫浸润。流产感染除了早期 cd4 + 和 CD8+ T细胞浸润外,几乎没有变化。
基因表达分析显示,干扰素应答基因是持续感染中主要的感染诱导模块。干扰素信号在血液和鼻咽部的所有细胞类型中都被激活,在血液中达到峰值的时间更早。大量 RNA-seq 数据验证了这种快速的全身反应。早期感染时观察到骨髓细胞在循环和组织之间的再分布。在所有感染组中检测到粘膜相关不变性 T (MAIT)细胞激活,表明快速的病毒感知。病毒 RNA 在第 7 天达到峰值,高度感染的纤毛细胞被认为是主要的病毒粒子产生者。
纤毛细胞表现出动态反应,包括急性期和干扰素刺激状态。通过多肽-主要组织相容性复合体 (MHC) 染色和 scRNA-seq 鉴定,激活的T细胞在接种后第 10 天显著扩增,类似于典型的抗原特异性适应性免疫反应。
研究结论
该研究揭示了临床症状之前的多种免疫反应状态,包括 MAIT 细胞激活和炎症单核细胞减少。即使在 SARS-CoV-2 暴露不会导致 COVID-19 的情况下,这些反应也会出现,这表明它们有可能成为即时免疫反应的生物标志物。在持续感染中,鉴定出纤毛细胞中新的急性期反应 (APR) 和具有 SARS-CoV-2 特异性 TCRs 的活化 T细胞的不同状态。干扰素信号在感染部位之前在循环免疫细胞中被全局激活。这些发现为 SARS-CoV-2 的早期免疫反应提供了详细的时间分辨描述。
期刊参考
Lindeboom, R.G.H., Worlock, K.B., Dratva, L.M. et al. Human SARS-CoV-2 challenge uncovers local and systemic response dynamics. Nature (2024). DOI- 10.1038/s41586-024-07575-x, https://www.nature.com/articles/s41586-024-07575-x
延展阅读
新研究显示感染 COVID-19 后患过敏性疾病的风险增加
研究揭示炎症在新冠病毒长期挥之不去的影响中的作用