曲霉菌病:日益严重的全球危机及应对策略

随着抗真菌药物耐药性的激增以及 COVID-19 大流行后严重感染的增加,曲霉病再次成为全球易感患者的重大威胁,凸显了快速诊断、新治疗方法和更强有力的公共卫生监测的迫切需求。

空气中塑料日益增多
曲霉病是由曲霉属真菌引起的一种感染,这类真菌常见于土壤、腐烂植被和室内环境中。虽然对大多数人无害,但对于免疫系统较弱、患有肺部疾病或过敏的人群,曲霉病可能导致严重疾病。
近年来,全球免疫功能低下人群的增加以及抗真菌药物耐药性的上升,使得曲霉病成为一个日益严重的问题。该病原体在医疗机构中引发疫情的潜力,进一步凸显了其作为新兴公共卫生威胁的重要性,需要提高认识和加强监测。1
本文探讨曲霉病,重点关注其在 COVID-19 大流行后的增长、抗真菌药物耐药性、诊断挑战及公共卫生影响。
什么是曲霉菌病?
曲霉病是指因吸入曲霉属霉菌(最常见的是烟曲霉)孢子而引起的一系列疾病。曲霉属产生的微小空气传播分生孢子直径通常为 2-3 微米(µm),这些病原体可进入肺泡,根据宿主的免疫状态和肺部状况被清除或引发疾病。2
传播途径是通过吸入环境中广泛存在的孢子,尤其是在堆肥、落叶和土壤等腐烂有机物中。曲霉病不会在人与人之间传播,但疫情常发生在真菌负荷较高的医疗机构中。
曲霉病的类型
了解曲霉病的不同类型对于早期诊断和针对性治疗至关重要。2 最常见的曲霉病类型包括过敏性支气管肺曲霉病(ABPA)、慢性肺曲霉病和侵袭性曲霉病。
ABPA 是一种过度免疫反应,主要发生在哮喘或囊性纤维化患者中,其特征为气道炎症、黏液栓和支气管扩张。
慢性肺曲霉病在患有基础肺部疾病的人群中发展,病程可持续数月或数年,常见症状包括咳嗽、体重减轻和疲劳。
侵袭性曲霉病是最严重的类型,常见于免疫功能低下患者,表现为组织侵袭并可能迅速扩散至肺部以外。2
高危人群
免疫功能低下的个体,如接受化疗的癌症患者、接受免疫抑制治疗的器官移植受者以及艾滋病(AIDS)患者,由于免疫系统较弱,特别容易感染曲霉病。患有慢性肺部疾病(如哮喘和慢性阻塞性肺病(COPD))的人群也面临较高风险,因为其受损的肺组织为曲霉属真菌的生长和侵袭提供了适宜环境。3
即使是传统风险因素的人群,在 COVID-19 等严重病毒感染后也可能发展为侵袭性肺曲霉病。事实上,近期研究表明,确诊为重症 COVID-19 的患者,尤其是需要机械通气或出现急性呼吸窘迫综合征的患者,常伴有烟曲霉共感染。COVID-19 与烟曲霉共感染与高死亡率相关,且常发生于非典型免疫功能低下的患者中。3
COVID-19 后白细胞介素-6(IL-6)和白细胞介素-10(IL-10)水平升高可能抑制免疫功能,从而增加对真菌感染的易感性。因此,曲霉病不仅成为已知免疫功能低下患者的关注焦点,也成为严重病毒性疾病康复患者的潜在威胁。提高认识和早期诊断检测对于发现所有危重患者的真菌共感染至关重要,无论其既往健康状况如何。3
再次出现与近期趋势
近期真菌感染的增加,尤其是 COVID-19 大流行后,归因于皮质类固醇的广泛使用以及重症病毒性疾病康复患者免疫反应的减弱。机会性真菌病原体,如耳念珠菌和烟曲霉,已成为侵袭性感染的元凶,甚至在既往健康人群中也是如此。值得注意的是,COVID-19 相关肺曲霉病和毛霉病已在印度等地引发疫情。4
抗真菌药物耐药性的增加进一步加剧了这一威胁,尤其是考虑到目前可用的抗真菌药物种类有限。例如,烟曲霉的唑类耐药菌株正在全球范围内出现,部分原因是农业中环境杀菌剂的使用。4
真菌病的地理分布也在发生变化。例如,球孢子菌病(山谷热)曾仅限于美国西南部部分地区,如今已扩散至新区域。研究人员预测,干旱和降雨交替的气候条件可能会扩大这些病原体的流行范围,并在 2100 年前将年病例数增加50%。4
气温上升、湿度增加以及飓风、野火和洪水等极端天气事件为真菌的繁殖和传播创造了有利条件。暴露于野火烟雾和洪水相关的霉菌污染也与系统性真菌感染的激增有关。4,7
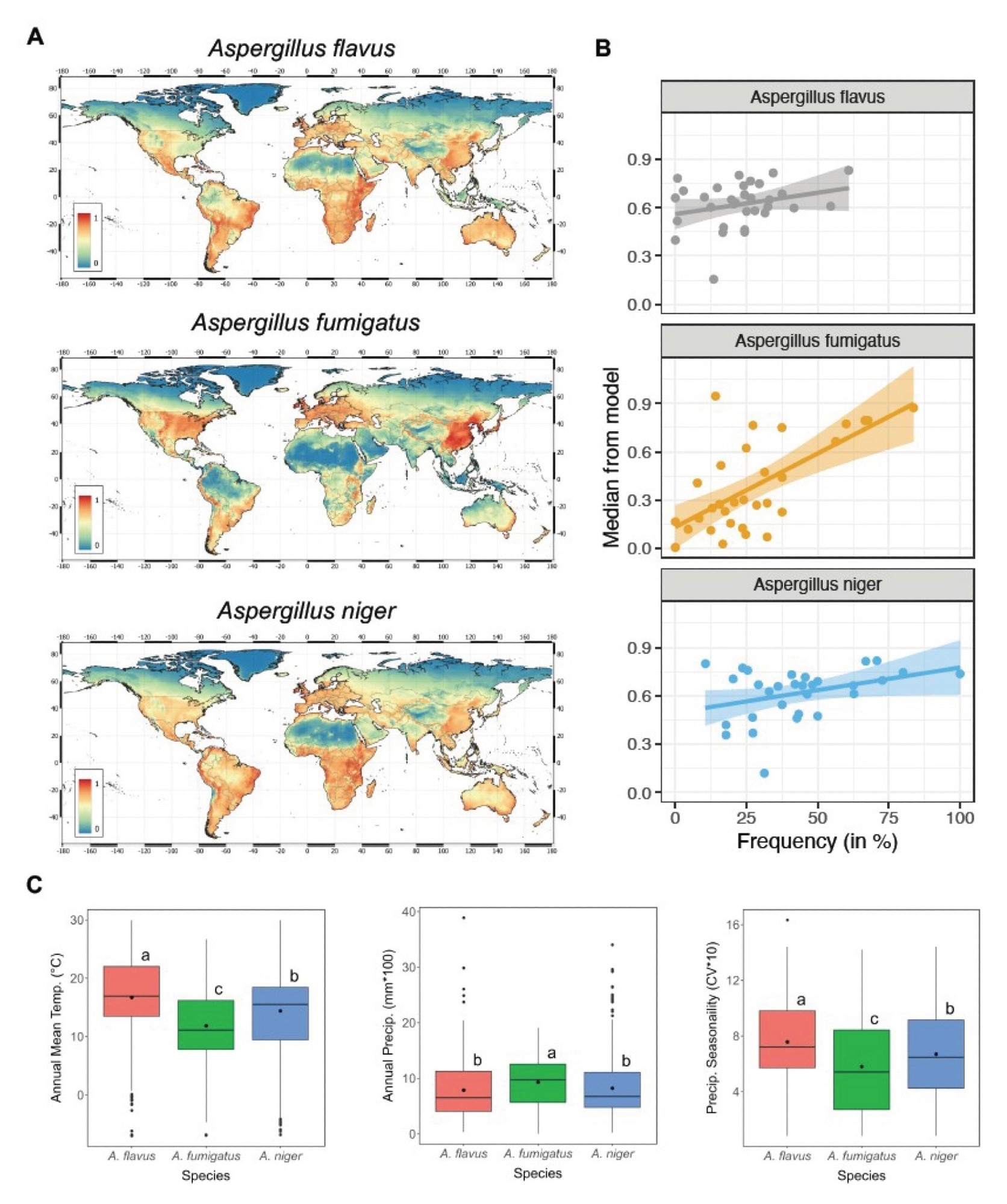
免疫抑制治疗、药物耐药性、生态变化和环境破坏凸显了加强真菌监测、研究和缓解策略的紧迫性,以应对日益严重的全球侵袭性真菌病威胁。4
诊断与治疗挑战
侵袭性曲霉病的诊断和治疗复杂且常被延误,原因是症状非特异性以及当前诊断方法的局限性。准确检测通常依赖于高分辨率计算机断层扫描(CT)、真菌培养以及半乳甘露聚糖检测、β-葡聚糖检测和聚合酶链反应(PCR)等实验室检查。尽管技术进步,晚期检测仍很常见,这增加了治疗结果不佳的风险。5
氟康唑的广泛使用(对霉菌无效)导致耐药真菌定植增加。伏立康唑和泊沙康唑等广谱抗真菌药物对曲霉病更有效,但即使在治疗期间,也有其他菌种引发突破性感染的报道。5
伏立康唑是目前治疗曲霉病的标准药物,与两性霉素B相比,其生存率更高。然而,伏立康唑可能直接或通过与其他药物相互作用引发不良反应。
棘白菌素类药物(如米卡芬净和卡泊芬净)为无法耐受标准治疗的患者提供了选择,但其高昂成本和静脉给药需求限制了广泛应用。目前的研究正在探索新药和诊断工具,以支持更早和更精准的干预。5
公共卫生影响
抗菌药物耐药性和医疗机构相关感染的增加给医疗系统带来了沉重负担,尤其是在低收入和中等收入国家。重症监护病房(ICU)尤为受影响,呼吸机相关肺炎和导管相关血流感染等导致住院时间延长、死亡率上升和医疗成本增加。疫情期间,ICU的有限容量成为关键挑战,凸显了预防策略的重要性。6
在资源匮乏地区,感染预防与控制计划以及抗菌药物管理计划面临重大障碍,包括专业人员短缺、诊断工具不足以及个人防护装备、消毒剂和隔离病房等基本物资的缺乏。此外,许多医院缺乏支持监测或及时诊断的基础设施,进一步增加了应对难度。6
许多监测系统薄弱或缺位,数据多来自少数医院且缺乏全国代表性,这些因素限制了对抗菌药物耐药性趋势的监测能力。抗生素的非处方广泛使用也加速了耐药菌株的出现。6
公共卫生应对措施应包括加大对监测网络的投资、强制实施管理计划以及整合“全健康”策略。确保诊断可及性、标准化协议和提高 ICU 准备度是保护易感人群和降低全球健康风险的关键步骤。6
研究结论
由于免疫功能低下人群增加、抗真菌药物耐药性上升以及环境条件变化,曲霉病再次成为全球重大健康问题。早期发现和及时治疗对于降低死亡率至关重要,尤其是对危重和免疫功能低下患者。
克服这一公共卫生威胁的持续挑战包括诊断延误、治疗选择有限以及 ICU 容量不足,这些问题亟需解决。公共卫生系统必须着力提高认识、加强监测并改进诊断和治疗工具。强化抗真菌药物管理和感染控制至关重要。持续的研究资金投入和国际合作是保护易感人群和管理这一日益严峻威胁的必要条件。
期刊参考
1. Mousavi, B., Hedayati, M. T., Hedayati, N., Ilkit, M., & Syedmousavi, S. (2016). Aspergillus species in indoor environments and their possible occupational and public health hazards. Current medical mycology, 2(1), 36. DOI: 10.18869/acadpub.cmm.2.1.36, https://pubmed.ncbi.nlm.nih.gov/28681011/
2. SISODIA, J., & Bajaj, T. (2023). Allergic bronchopulmonary aspergillosis. In StatPearls [Internet]. StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK542329/
3. Lai, C. C., & Yu, W. L. (2021). COVID-19 associated with pulmonary aspergillosis: A literature review. Journal of Microbiology, Immunology and Infection, 54(1), 46-53. DOI: 10.1016/j.jmii.2020.09.004, https://www.sciencedirect.com/science/article/pii/S1684118220302383
4. Konkel Neabore, L. (2024). Wake-up call: rapid increase in human fungal diseases under climate change. DOI: 10.1289/EHP14722, https://ehp.niehs.nih.gov/doi/full/10.1289/EHP14722
5. Baddley, J. W., & Apewokin, S. (2008). Prevention of invasive aspergillosis in high-risk patients: Universal versus preemptive, targeted treatment. Current fungal infection reports, 2(2), 61-68. DOI:10.1007/s12281-008-0010-6, https://link.springer.com/article/10.1007/s12281-008-0010-6
6. Abbas, S. (2024). The challenges of implementing infection prevention and antimicrobial stewardship programs in resource-constrained settings. Antimicrobial Stewardship & Healthcare Epidemiology, 4(1), e45. DOI:10.1017/ash.2024.35, https://www.cambridge.org/core/journals/antimicrobial-stewardship-and-healthcare-epidemiology/article/challenges-of-implementing-infection-prevention-and-antimicrobial-stewardship-programs-in-resourceconstrained-settings/BE2C4293F06F6B03834972F5149050A5
7. Norman van Rhijn, Christopher Uzzell, Jennifer Shelton et al. Climate change-driven geographical shifts in Aspergillus species habitats and their implications for plant and human health. Research Square (2025). DOI: 10.21203/rs.3.rs-6545782/v1, https://www.researchsquare.com/article/rs-6545782/v1
延展阅读
古生菌:人类微生物群和传染病中看不见的玩家
研究表明隐真菌病原体威胁人类健康和粮食安全