气候危机下的致命病毒:亨德拉病毒如何威胁人类与动物?

气候变化与栖息地破坏正使蝙蝠、马匹和人类之间的接触日益密切,从而加剧了亨德拉病毒的传播。探索 “One Health” 方法如何切断传播链,为防范未来疫情提供保护。

简介
亨德拉病毒(HeV)属于副粘病毒科(Paramyxoviridae)的亨尼帕病毒属(Henipavirus)。该病毒于 1994 年在澳大利亚布里斯班郊区亨德拉的一次马匹致命性呼吸道疾病暴发中首次被发现。此次疫情涉及 21 匹马,其中 14 匹死亡或被安乐死,同时导致两例人类感染,包括一例死亡病例。
自发现以来,昆士兰州和新南威尔士州陆续报告了零星疫情,主要传播途径为狐蝠传染给马匹,偶尔通过马匹传染给人类。此外,还记录了一例犬类感染病例,凸显了亨德拉病毒跨物种传播的潜力。
病毒学与致病机制
新变种的出现:2021 年,科学家发现了一种名为“亨德拉病毒基因 2 型”(HeV-g2)的新变种在澳大利亚狐蝠中传播,其与原始毒株的基因相似性仅为 84%,且已导致马匹感染。
亨德拉病毒是一种有包膜的多形性病毒,形态从球形颗粒到长丝状结构不等。其包膜上的附着糖蛋白(G)和融合蛋白(F)能够与宿主细胞表面的 ephrin B2 和 B3 受体结合,介导病毒进入细胞。
病毒基因组为单股负链不分节段的 RNA,由核衣壳蛋白(N)包裹形成核糖核蛋白复合体(RNP),该复合体能够拮抗宿主的先天免疫反应。
亨德拉病毒的自然宿主为狐蝠(Pteropus属),包括黑狐蝠(P. alecto)、灰头狐蝠(P. poliocephalus)、小红狐蝠(P. scapulatus)和眼镜狐蝠(P. conspicillatus)等。病毒通过马匹摄入或吸入被蝙蝠排泄物或尿液污染的食物或水源而传播。
人类感染通常是由于密切接触感染马匹及其体液(如血液、鼻腔分泌物和唾液)所致。截至目前,尚未发现人际传播病例。
尽管人类感染罕见,但病情通常较为严重,初期表现为流感样症状,可能进展为脑炎或呼吸衰竭。亨德拉病毒的致死率高达 57%,且尚无获批的治疗方法,因此被列为需生物安全 4 级(BSL4)防护的高优先级人畜共患病原体。
生态驱动因素
犬类也可能感染:除马匹和人类外,2011 年曾有一例澳大利亚卡尔比犬“达斯蒂”在接触病马后检出亨德拉病毒抗体,最终根据政府政策被安乐死。
亨德拉病毒的暴发与生态破坏密切相关,尤其是栖息地丧失和气候变化。农业、采矿和城市开发导致的大规模土地清理活动破坏了自然栖息地,迫使狐蝠迁移至更接近人类和马群的区域。
干旱、食物短缺和极端温度压力扰乱了蝙蝠的觅食、迁徙和栖息模式,迫使狐蝠进入果园、牧场和居民区,增加了马匹接触污染排泄物的风险。
气候变化通过改变蝙蝠分布范围、开花模式和加剧干旱,进一步扩大了亨德拉病毒的高风险溢出区域。桉树开花减少和栖息地丧失迫使狐蝠进入城市,增加了病毒释放的压力。
这些因素共同增加了病毒溢出风险,尤其是在澳大利亚东部 8 月至 12 月的马匹产驹季节,与冬季重叠。黑狐蝠向新南威尔士州上亨特等马匹密集区域的南迁,凸显了气候驱动的生态变化如何加剧人畜共患威胁。
监控与检测
致死率惊人:人类感染致死率约为 60%,马匹感染致死率高达 75%,突显了该病毒的严重性。
有效的监测和早期检测可以预防亨德拉病毒的溢出事件,从而保护人类和动物健康。定量逆转录聚合酶链反应(qRT-PCR)可在 4 小时内检测马匹血液或拭子样本中的病毒抗原水平。
病毒分离(通过鼻咽或口咽拭子以及凝血样本)也可用于确诊。酶联免疫吸附试验(ELISA)能够检测凝血样本中的抗亨德拉病毒抗体,为流行病学追踪提供依据。此外,对蝙蝠和马匹的血清学监测有助于识别高风险区域,指导疫苗接种和生物安全策略。
蝙蝠的亚临床感染和间歇性排毒,以及马匹的非特异性或突发症状,增加了诊断难度。关键物种(如黑狐蝠)的监测不足和农村地区诊断资源有限,也导致漏报现象严重。
预防与控制策略
尽管缺勤和整体健康状况被预设为综述的主要结果,但纳入的研究均未报告这些指标。这为了解汤对功能恢复、生活质量和日常活动回归的影响留下了重要空白,而这些对在职成年人和照顾者至关重要。
兽医干预措施
Equivac® HeV 亚单位疫苗于 2012 年研发,用于预防马匹感染亨德拉病毒。该疫苗包含可溶性 G 糖蛋白,接种程序为初始两剂、6 个月后第三剂和年度加强剂。通过诱导保护性抗体,疫苗可防止马匹致命性感染并阻断蝙蝠-马-人传播链。
然而,由于对制药公司的不信任、成本担忧、风险认知不足和安全有效性误解,疫苗接种率仍然较低。通过透明沟通、激励措施和兽医主导的推广活动,可以提高高风险区域的接种覆盖率,保护动物和人类健康。
人类风险缓解
人类感染风险防控依赖于严格的个人防护装备(PPE)使用,尤其是在护理或解剖马匹时。完整的 PPE 包括手套、呼吸器或口罩、防护服、面罩和防护鞋,可有效保护兽医和马匹饲养者。
针对兽医和马主的公共卫生教育也至关重要,包括早期症状识别、疫苗接种推广、基础生物安全措施和 PPE 使用培训。开放的沟通有助于建立信任,鼓励及时报告,降低溢出风险。
生态干预措施
疫情具有明显季节性:被称为“亨德拉季节”的溢出事件主要集中在 5 月至 10 月,与蝙蝠冬季觅食栖息地的聚集以及温暖潮湿的病毒传播条件相吻合。
减少狐蝠与家畜接触的生态干预措施是预防溢出的关键。保护和恢复蝙蝠自然栖息地(如在远离农场处种植果树和开花植物)可以减少蝙蝠进入牧场的机会,从而降低病毒释放风险。
通过设置围栏、在马匹活动高峰期迁移马匹,以及将饲料和水源远离蝙蝠频繁活动的树木,建立蝙蝠栖息地与马匹活动区的缓冲带,结合农场生物安全措施,可有效降低高风险区域的溢出风险。
更广泛的人畜共患意义
亨德拉病毒与尼帕病毒(NiV)同属亨尼帕病毒属,均可引发严重的人畜共患疫情。亨德拉病毒主要在澳大利亚影响马匹和人类,而尼帕病毒在东南亚导致人类致命感染,部分疫情致死率高达 100%。
两者的基因相似性和广泛的宿主范围引发了人们对病毒进化或重组的担忧,尤其是在栖息地丧失、气候变化和跨物种接触增加的背景下,可能为病毒适应和潜在的人际传播创造条件。
这些风险凸显了 “One Health” 方法的重要性,即通过协调监测、生态保护、疫苗接种和教育,统筹动物、人类和环境健康,预防未来溢出事件。
研究空白与未来方向
溢出预测模型需整合气候数据、蝙蝠生态学、温度、森林覆盖率、土地利用变化、人口密度和马匹管理实践。尽管已有马用疫苗,但目前尚无获批的人用疫苗或抗病毒疗法。候选疫苗(如亚单位人用疫苗)和单克隆抗体 m102.4 的安全性和有效性仍在评估中。
此外,需开展纵向研究以阐明气候变化、营养压力、蝙蝠繁殖周期和栖息地碎片化如何影响病毒释放和传播。这些成果将有助于优化疫情预测和预防策略。
鉴于蝙蝠在全球的分布及其在病毒溢出中的作用,国际合作对防控亨德拉病毒至关重要。加强跨境监测、数据共享以及诊断、疫苗和治疗的协同研究,将提升全球应对亨德拉病毒和其他蝙蝠源性病原体的能力。
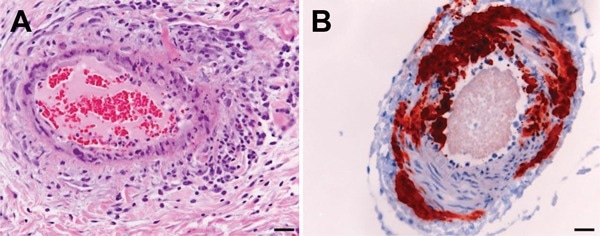
图:亨德拉病毒感染马匹组织的病理学与免疫组织化学表现。A) 苏木精-伊红染色显示肺部系统性血管炎;B) 使用多克隆兔抗尼帕病毒N蛋白的免疫组化检测显示脑部血管中的亨德拉病毒抗原。比例尺为 50 微米。
研究结论
预防未来亨德拉病毒暴发需要采取跨学科的主动措施。监测工作需包括对宿主物种的生态追踪以实现早期预警。保护和恢复蝙蝠栖息地能够减少人与动物的接触,从根本上降低溢出风险。
“One Health” 方法结合兽医学、生态学、气候学、公共卫生和社会科学,是制定和实施有效预防策略的核心。通过将生态保护与针对性监测及跨部门协作相结合,可以增强对亨德拉病毒及其他环境变化驱动的新发人畜共患威胁的抵御能力。
期刊参考
Christopher C. Broder et al. (2013). A treatment for and vaccine against the deadly Hendra and Nipah viruses. Antiviral Research, 100 (1):8-13. DOI: 10.1016/j.antiviral.2013.06.012, https://www.sciencedirect.com/science/article/pii/S0166354213001691
Yuen KY et al. (2021). Hendra virus: Epidemiology dynamics in relation to climate change, diagnostic tests and control measures. One Health,12:100207. DOI: 10.1016/j.onehlt.2020.100207. https://www.sciencedirect.com/science/article/pii/S2352771420303086?via%3Dihub
Kessler MK et al. (2018). Changing resource landscapes and spillover of henipaviruses. Ann N Y Acad Sci., 1429(1):78-99. DOI: 10.1111/nyas.13910. https://nyaspubs.onlinelibrary.wiley.com/doi/10.1111/nyas.13910
Christina L. Faust. (2023). Environmental variation across multiple spatial scales and temporal lags influences Hendra virus spillover. Journal of Applied Ecology, 60, 1457–1467. DOI: 10.1111/1365-2664.14415. https://besjournals.onlinelibrary.wiley.com/doi/10.1111/1365-2664.14415
Broder CC, Weir DL, Reid PA. (2016). Hendra virus and Nipah virus animal vaccines. Vaccine, 34 (30) 3525-34. DOI: 10.1016/j.vaccine.2016.03.075. https://www.sciencedirect.com/science/article/abs/pii/S0264410X1630072X
Walsh, M.G., Wiethoelter, A. & Haseeb, M.A. (2017). The impact of human population pressure on flying fox niches and the potential consequences for Hendra virus spillover. Sci Rep 7, 8226. DOI: 10.1038/s41598-017-08065-z. https://www.nature.com/articles/s41598-017-08065-z
Baranowski K, Bharti N. (2023). Habitat loss for black flying foxes and implications for Hendra virus. Landsc Ecol., 38(6):1605-1618. DOI: 10.1007/s10980-023-01642-w. https://link.springer.com/article/10.1007/s10980-023-01642-w
Eby P et al. (2023). Pathogen spillover driven by rapid changes in bat ecology. Nature, 613(7943):340-344. DOI: 10.1038/s41586-022-05506-2. https://www.nature.com/articles/s41586-022-05506-2
Goldspink LK, Edson DW, Vidgen ME, Bingham J, Field HE, and Smith CS. (2015). Natural Hendra Virus Infection in Flying-Foxes - Tissue Tropism and Risk Factors. PLoS One, 10(6):e0128835. DOI: 10.1371/journal.pone.0128835. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0128835
Edson D et al. (2015). Routes of Hendra Virus Excretion in Naturally-Infected Flying-Foxes: Implications for Viral Transmission and Spillover Risk. PLoS ONE, 10(10): e0140670. DOI: 10.1371/journal.pone.0140670. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0140670
Hazelton, B., Ba Alawi, F., Kok, J., and Dwyer, D. E. (2013). Hendra Virus: A One Health Tale of Flying Foxes, Horses and Humans. Future Microbiology, 8(4), 461–474. DOI: 10.2217/fmb.13.19. https://www.tandfonline.com/doi/10.2217/fmb.13.19
Jessica N Kropich-Grant, Kerrie E Wiley, Jennifer Manyweathers, Kirrilly R Thompson, and Victoria J Brookes. (2023). Communication Interventions and Assessment of Drivers for Hendra Virus Vaccination Uptake. Vaccines, 11, 936. DOI: 10.3390/ vaccines11050936. https://www.mdpi.com/2076-393X/11/5/936
Middleton D. (2014). Hendra virus. Vet Clin North Am Equine Pract., 30(3):579-89. DOI: 10.1016/j.cveq.2014.08.004. https://www.sciencedirect.com/science/article/abs/pii/S0749073914000625?via%3Dihub
Plowright RK et al. (2024). Ecological countermeasures to prevent pathogen spillover and subsequent pandemics. Nat Commun., ;15(1):2577. DOI: 10.1038/s41467-024-46151-9. https://www.nature.com/articles/s41467-024-46151-9
Middleton D et al. (2014). Hendra virus vaccine, a one health approach to protecting horse, human, and environmental health. Emerg Infect Dis.;20(3):372-9. DOI: 10.3201/eid2003.131159. https://wwwnc.cdc.gov/eid/article/20/3/13-1159_article
Jagadesh S. et al. (2025). Mapping global risk of bat and rodent-borne disease outbreaks to anticipate emerging threats. Sci Rep.;15(1):20534. DOI: 10.1038/s41598-025-05588-8. https://www.nature.com/articles/s41598-025-05588-8
延展阅读
世界卫生组织:基孔肯雅热全球流行病学与防控策略——现状与挑战
世卫组织拉响警报:奥罗普切病毒(OROV)全球蔓延,恐成下一场卫生危机!