基因发现揭示炎症疾病的关键


在最近发表在《Nature》杂志上的一项研究中,一组研究人员研究了在 21 号染色体长臂上发现的基因间单倍型。该单倍型与高安动脉炎、强直性脊柱炎、炎症性肠病和原发性硬化性胆管炎等炎症性疾病具有独立的关联。研究人员进行了功能基因组分析,以更好地了解炎症性疾病的机制。

研究背景
炎症和自身免疫性疾病影响着全球约 5% 的人口,并且具有高度异质性,影响着身体的各个部位。目前缺乏有效的治疗方法来治疗炎症性疾病,如炎症性肠病、狼疮和牛皮癣等,只有不到 10% 的正在接受临床试验的药物被批准使用。对炎症性疾病机制的了解不足是炎症性疾病疗法疗效低下的主要原因。
然而,遗传学的进步和大量基因位点的定位为研究与疾病发病机制直接相关的基因位点提供了途径。识别这些基因位点所涉及的通路为开发专门针对这些通路的药物提供了机会。
关于该项研究
在本研究中,研究人员调查了共同的疾病机制,旨在确定决定多种炎症疾病易感性的遗传变异。他们确定了第 21条染色体长臂 (q) 第 22 位上的基因间区域(chr21q22),其中包含决定五种炎症疾病易感性的单倍型。
他们进行了共定位分析,以测试这五种疾病的发病机制是否相同。他们假设,由于这五种炎症疾病都是免疫介导的,因此 chr21q22 位点与免疫功能有关。
该研究基于 chr21q22 位点在免疫机制中具有远端增强子功能的假设,利用染色质免疫沉淀测序技术来识别活性启动子和增强子。
研究人员结合人类单核细胞表达定量位点数据和启动子捕获 Hi-C,扫描了靠近 chr21q22 位点的大量基因,以确定哪个基因受到 chr21q22 位点的增强子调控。
然后使用集群的规律间隔短回文重复序列 (CRISPR)/CRISPR 相关蛋白 9 (Cas9) 系统来确认所识别基因的因果作用。为此,研究人员使用 CRISPR/Cas9 选择性地删除了人类单核细胞中的增强子区域,然后将这些改变的单核细胞与炎症配体(例如前列腺素 E2 和肿瘤坏死因子,它们分别是促炎脂质和细胞因子)和 Toll 样受体激动剂 Pam3CSK4 一起培养。
然后测量所有候选基因的信使核糖核酸 (mRNA) 表达水平,以确定哪个基因受到 chr21q22 增强子缺失的影响。然后使用来自炎症性肠病全基因组关联研究的数据来确定增强子的致病变异。
所选单核苷酸多态性之间存在高度连锁不平衡,因此很难确定增强子的致病变异。因此,大规模并行报告基因检测有助于筛选大量短脱氧核糖核酸 (DNA) 序列以检测增强子活性。
研究结果
研究发现,chr21q22 上的基因间区域增强了红细胞转化特异性原癌基因2(ETS2),该基因集中调节人类的炎症巨噬细胞。
研究发现,患病组织显著表达受 ETS2 蛋白调控的基因。这些基因在炎症性肠病的全基因组关联研究数据中也比其他途径更加丰富。
此外,当ETS2在巨噬细胞中过度表达时,与 chr21q22 位点相关的五种炎症疾病中观察到的炎症状态被重新建立,并且各种药物靶点,例如白细胞介素 23 和肿瘤坏死因子被上调。
研究人员还旨在确定炎症疾病的潜在治疗方法。其中之一是使用丝裂原活化蛋白激酶激酶或 MEK 抑制剂来阻断 ETS2 信号传导,这可以靶向多种细胞因子。然而,这种方法可能有许多副作用,因为 MEK 在其他组织中也发挥着各种作用。
因此,研究人员认为,使用靶向蛋白水解的嵌合分子或 PROTACs 直接靶向 ETS2 蛋白,或使用抗体-药物偶联物选择性地将 MEK 抑制剂递送至巨噬细胞,可以避免副作用并成功阻断基于 ETS2 的炎症。
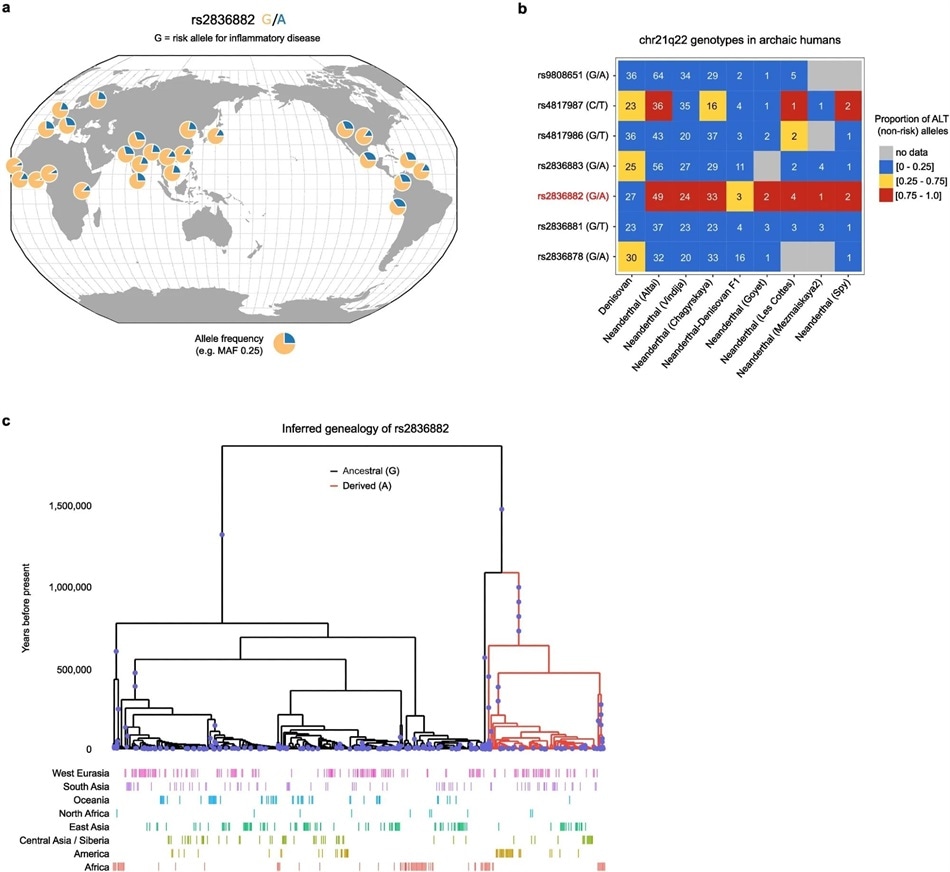
图:rs2836882 的地理分布和历史。
a。现代全球人口中的 rs2836882 等位基因频率(数据来自千人基因组计划,使用遗传变异地理浏览器绘制: https://popgen.uchicago.edu/ggv/) 。b. 古人类(尼安德特人和丹尼索瓦人)chr21q22(99% 可信集)处候选 SNP 的基因型。颜色表示含有 ALT 等位基因的读数比例,接近 0 的值与纯合 REF(风险)基因型一致,接近 1 的值与纯合 ALT(非风险)基因型一致,中间值表示潜在的杂合基因型。每个单元格中的数字表示所示样本中该 SNP 处的读数数量。推定的因果变异以红色突出显示。c .推断的 rs2836882 多态性年龄谱系 - 使用 Relate 分析。a 中的图表 是 使用遗传变异地理浏览器创建的。
研究结论
总体而言,研究结果表明ETS2基因在 chr21q22 上的基因间区域得到增强,这与五种炎症性疾病有关。直接针对 ETS2 蛋白或选择性抑制巨噬细胞中 ETS2 信号传导的方法可能是治疗炎症疾病的潜在方法。
期刊参考
C. T. Stankey, C. Bourges, L. M. Haag, T. Turner-Stokes, et al. (2024). A disease-associated gene desert directs macrophage inflammation through ETS2. Nature. DOI: 10.1038/s41586024075011, https://www.nature.com/articles/s41586-024-07501-1