当T细胞几乎不表达ACE-2受体时,SARS-CoV-2是如何引起淋巴细胞减少的?

在最近发表在《Cell Communication and Signaling》杂志上的篇综述中,埃及和美国的一组研究人员探讨了与 T淋巴细胞相关的适应性抗病毒免疫反应的直接和间接机制,这些反应可能导致与 SARS-CoV-2 感染相关的淋巴细胞减少。

研究背景
尽管在全球范围内努力接种疫苗之后,COVID-19 大流行的传播和严重程度已得到了遏制,但由于其核糖核酸(RNA)的突变不断积累,SARS-CoV-2 仍在继续进化。虽然其中一些突变降低了毒性和传染性,但其他突变也有助于病毒逃避疫苗诱导的免疫。
当 SARS-CoV-2 触发宿主免疫时,观察到的主要免疫病理学特征是低适应性免疫反应和不受控制的炎症反应,包括细胞因子风暴和干扰素异常产生。特别值得关注的是,在严重的 COVID-19 患者中观察到淋巴细胞减少。
当刺突蛋白与细胞表面的血管紧张素转换酶-2 (ACE-2) 受体结合时,SARS-CoV-2 就会入侵细胞。鉴于辅助性 T细胞 (CD4+) 和细胞毒性 T细胞 (CD8+) 在其表面不表达许多 ACE-2 受体,与 SARS-CoV-2 相关的淋巴细胞减少的原因尚不清楚。
人类免疫机能丧失症相关淋巴细胞减少症的机制

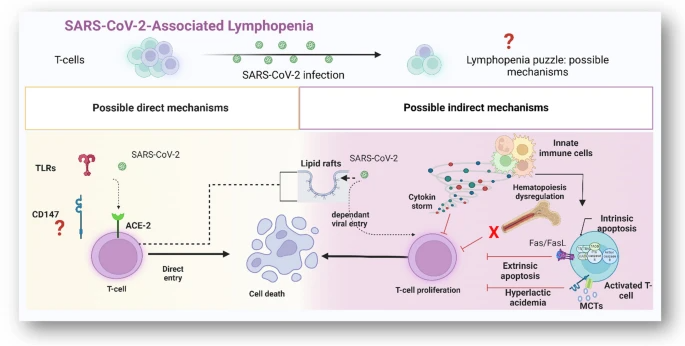
图:SARS-CoV-2 病毒感染淋巴减少症可能机制的示意图。
本文讨论了 SARS-CoV-2 感染可能导致 CD8+ 和 CD4+ T细胞减少的直接和间接机制。在尸体解剖的 T细胞中检测到针对 SARS-CoV-2 的病毒 RNA 或抗原,表明该病毒可能直接导致淋巴细胞减少,而不会表现为淋巴细胞中的病毒感染。
由于 T细胞对病毒颗粒的摄取,T细胞中干扰素-γ (IFN-γ)、穿孔素、颗粒酶和白细胞介素(IL) 17 和 2 的产生增加,可能导致衰竭和细胞死亡。这一机制还表明,SARS-CoV-2 可能有一种独立于 ACE-2 受体的感染细胞的方法。
计算分析已经确定了白细胞表面的各种趋化因子受体、粘附分子和其他分子,这些分子可以与 SARS-CoV-2 刺突蛋白的受体结合域结合。
SARS-CoV-2 感染也可能通过间接机制降低淋巴细胞数量。免疫系统增加对反应性 T细胞、中性粒细胞和巨噬细胞的招募和刺激,以释放病毒,也导致促炎细胞因子如 IL-6 的过量产生,被称为细胞因子风暴。这种细胞因子风暴会导致淋巴细胞生成中止,最终导致淋巴细胞减少。
重症 COVID-19 患者血浆乳酸水平升高,导致代谢性酸中毒,抑制淋巴细胞增殖,并经常导致多器官衰竭。感染期间来自线粒体的活性氧的积累也导致缺氧诱导因子1 (HIF-1) 的稳定,从而促进促炎单核细胞的刺激并抑制t细胞反应。
此外,对禽类传染性支气管炎病毒、人类免疫缺陷病毒和小鼠肝炎病毒的研究表明,病毒感染可直接引起 T细胞凋亡。然而,SARS-CoV-2 是否也是如此仍有待确定。值得注意的是,感染 SARS-CoV-2 的人外周血单核细胞显示出凋亡相关基因的上调。
SARS-CoV-2 间接引起淋巴细胞减少的另一种可能机制包括通过直接影响造血干细胞或祖细胞来调节造血功能失调。这种病毒还可以影响次级淋巴器官,如脾脏和淋巴结,通过感染这些器官中的树突状细胞和巨噬细胞,增加促炎细胞因子的产生。
激活的 T细胞细胞膜上富含胆固醇的脂筏的存在也可能为 SARS-CoV-2 进入细胞提供平台,导致病毒在缺乏 ACE-2 受体的情况下感染T细胞。
病毒通过 CD147 进入
本综述还探讨了病毒通过 1型跨膜糖蛋白 CD147 进入 T细胞的可能性。这种多效性分子属于免疫球蛋白超家族,可以为病毒提供进入 T细胞的替代途径,因为它参与各种细胞过程,如与基质金属蛋白酶、亲环蛋白和单羧酸转运蛋白的相互作用和调节。
基质金属蛋白酶刺激细胞融合的能力也可能增加病毒的传播。此外,CD147 和亲环蛋白A 之间的相互作用介导了导致炎症的细胞内通路。
研究结论
总之,本综述讨论了 SARS-CoV-2 感染降低 T辅助细胞和细胞毒性 T细胞数量,导致淋巴细胞减少的许多可能的直接和间接机制。
研究结果表明,尽管T细胞几乎不表达 ACE-2 受体,但 SARS-CoV-2 通常通过这种受体感染宿主细胞,但病毒可以通过多种机制感染 T细胞,包括通过其他潜在途径和受体直接感染,如 CD147 和脂质筏。此外,已经在许多严重的 COVID-19 病例中观察到的由此产生的细胞因子风暴也被认为会导致t细胞衰竭和淋巴生成减少。
期刊参考
Shouman, S., El-Kholy, N., Hussien, A. E., El-Derby, Azza M, Magdy, S., Abou-Shanab, A. M., Elmehrath, A. O., Abdelwaly, A., Helal, M., & El-Badri, N. (2024). SARS-CoV-2-associated lymphopenia: possible mechanisms and the role of CD147. Cell Communication and Signaling, 22(1), 349. DOI:10.1186/s12964024017183 https://biosignaling.biomedcentral.com/articles/10.1186/s12964-024-01718-3
延展阅读
研究揭示炎症在新冠病毒长期挥之不去的影响中的作用
新研究显示感染 COVID-19 后患过敏性疾病的风险增加